Os princípios para a fabricação de implantes ativos ou não ativos
Redação
Há pelo menos 8.000 tipos de dispositivos médicos disponíveis para uso, segundo informações da Organização Mundial da Saúde (OMS). Esses dispositivos ou tecidos inseridos dentro do corpo ou sob a pele podem ser feitos de pele, osso, outros tecidos do corpo e até mesmo de metal, plástico ou cerâmica. A maioria destes implantes ou próteses tem por objetivo substituir um membro ou uma parte do corpo. Outros liberam gradativamente medicação, monitoram as funções corporais ou proveem suporte a órgãos e tecidos. Alguns exemplos de dispositivos médicos implantáveis são: stents, marca-passos, cardiodesfibriladores, próteses e órteses, placas e parafusos. Deve-se conhecer os princípios fundamentais para o projeto e fabricação de implantes ativos ou não ativos, para que cada um deles possa atingir o objetivo pretendido.
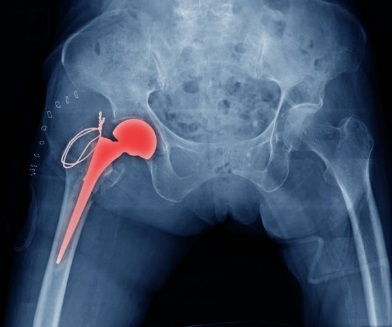
Os implantes ou os dispositivos médicos implantáveis podem ser permanentes ou removíveis, quando deixarem de ser necessários. Por exemplo, stents ou implantes de quadril tendem a ser permanentes, mas acessos para quimioterapia ou pinos para reparação de ossos quebrados são removidos após o tratamento. Os riscos associados à sua inserção incluem riscos cirúrgicos – durante a inserção ou retirada -, de infecção do local e de falha do implante. Algumas pessoas podem desenvolver reações aos materiais do dispositivo.
Dessa forma, eles são qualquer instrumento, aparelho, equipamento, software, material ou artigo, utilizado isoladamente ou em combinação, introduzido no corpo humano para fins de diagnóstico, prevenção, controle, tratamento, atenuação ou compensação de uma doença, lesão ou deficiência. A Agência Nacional de Vigilância Sanitária propõe este conceito para o termo: qualquer produto médico projetado para ser totalmente introduzido no corpo humano ou para substituir uma superfície epitelial ou ocula...



















