A Qualidade na coleta de sangue humano
Redação
Embora a prevenção seja a melhor alternativa para diminuir a incidência das doenças sexualmente transmissíveis (DST) e acquired immunodeficiency syndrome (Aids), o diagnóstico e o tratamento precoces diminuem as complicações e os efeitos psicossociais dessas patologias. O correto diagnóstico laboratorial depende da coleta adequada das amostras de sangue para testes. A coleta de amostras de sangue para testes sorológicos deve ser realizada preferencialmente com o paciente em jejum. Nos testes sorológicos para diagnósticos dessas doenças, o fato de o paciente não estar em jejum não impede a coleta, a menos que ele tenha ingerido alimentos gordurosos, nas últimas três horas. Dessa forma, devem ser conhecidos os requisitos normativos e os métodos de ensaio para os recipientes de uso único para a coleta de amostras de sangue venoso com e sem vácuo.
Da Redação –
Segundo o Ministério da Saúde, existem condições ideais para a coleta de sangue, como uma sala bem iluminada e ventilada, pia, cadeira reta com braçadeira regulável ou maca garrote, algodão hidrófilo, álcool iodado a 1% ou álcool etílico a 70%, agulha descartável, seringa descartável, sistema a vácuo: suporte, tubo e agulha descartável, tubos de ensaio com tampa, pinça, pipetas Pasteur, etiquetas para identificação de amostras, caneta, recipiente de boca larga, com parede rígida e tampa, contendo hipoclorito de sódio a 2%, avental e máscara luvas descartáveis e estantes para tubos.
Antes de ser feito antes a coleta da amostra de sangue, deve-se identificar os tubos para colocação da amostra. Escreva na etiqueta os dados do paciente: nome, número do registro, data de nascimento, sexo, data da coleta, número ou código de registro da amostra e o nome da instituição solicitante. Em algumas unidades, utiliza-se apenas códigos ou abreviaturas em lugar do nome do paciente.
Todo cuidado é pouco na manipulação de materiais biológicos, tais como soro, sangue ou secreções, fluidos orgânicos, tecidos etc. Redobre suas precauções, pois esses materiais são potencialmente infectantes e muitas vezes estão contaminados com agentes etiológicos diferentes do que se está pesquisando, ou ainda desconhecidos. Nunca pipete com a boca e jamais cheire placas de cultura.
A inativação do soro em banho-maria a 56°C por 30 minutos não elimina o potencial infectante da amostra. Lembre-se de que, com a automação, aumentou muito o número de amostras processadas em laboratório e, consequentemente, aumentou também o risco de contaminação.
Dessa forma, é difícil afirmar que um profissional se contaminou, de fato, em serviço. Isso faz com que as doenças infectocontagiosas causadas por acidentes de trabalho não sejam devidamente notificadas e, em consequência, as medidas de segurança envolvendo o biorrisco acabam não sendo implementadas.
Use sempre o Equipamento de Proteção Individual (EPI): avental ou jaleco longo de mangas compridas e punho retrátil, luvas descartáveis, óculos de proteção, pipetadores manuais ou automáticos e, quando for o caso, protetor facial. Os EPI são regulamentados pelo Ministério do Trabalho e seu uso visa a minimizar a exposição do técnico aos riscos e evitar possíveis acidentes nos laboratórios.
Às vezes, os profissionais de laboratório precisam de um tempo para se adaptar ao uso dos equipamentos na sua rotina. O importante é que ele se adapte e incorpore a utilização dos EPI à sua prática profissional. O uso indevido dos EPI, ao invés de proteger, poderá ocasionar acidentes.
Evite a formação e dispersão de aerossóis, já que eles são micropartículas sólidas e líquidas com dimensões aproximadas entre 0,1 e 50 micra que podem, caso contenham micro-organismos, permanecer em suspensão e plenamente viáveis por várias horas. A pipetagem, flambagem de alças, abertura de frascos e ampolas, manipulação de seringas, agulhas, lancetas, lâminas e outros assemelhados podem gerar e propagar aerossóis.
A abertura de frascos, ampolas, tubos e garrafas de cultura requer cuidados especiais. Envolva a parte a ser aberta com um pedaço de gaze. Utilize um pedaço de gaze para cada material, prevenindo assim a contaminação cruzada. Descarte-a imediatamente em hipoclorito de sódio a 2%.
Centrífugas, agitadores e maceradores, quando manipulados sem as precauções e abertos antes da total parada ou término da operação, igualmente podem contaminar o ambiente laboratorial. Deve-se lembrar que é importante a redução ao máximo do manuseio de resíduos, em especial os perfurocortantes. Descarte o rejeito perfurocortante diretamente em recipiente de paredes rígidas, contendo hipoclorito de sódio a 2%. Deixe em imersão total no mínimo por 24 horas e, em seguida, faça a autoclavação desse material.
Esta é uma regra básica para diminuir os riscos de acidente nos laboratórios. É fundamental que os materiais perfurocortantes sejam autoclavados depois da imersão em hipoclorito de sódio a 2%. Só então esses materiais devem ser encaminhados ao lixo hospitalar. O acondicionamento dos resíduos de laboratório deve seguir a norma técnica que recomenda os sacos brancos leitosos para os resíduos potencialmente infectantes e hospitalares, e os escuros para o lixo comum. Os profissionais responsáveis pela limpeza e conservação devem ser bem orientados e usar equipamentos de proteção.
Todos os recipientes para descarte devem estar identificados. Lembre-se de que, pela legislação brasileira, quem gera o resíduo é o responsável pela sua eliminação e controle. No caso dos materiais reutilizáveis, como vidraria e utensílios, deposite-os em recipiente contendo o desinfetante próprio, pelo tempo de contato recomendado e, em seguida, faça a autoclavação. Depois, lave normalmente esses materiais e guarde-os para uso posterior.
Pode-se destacar que a coleta de exames laboratoriais de pacientes em regime de internação e em situação ambulatorial nos laboratórios de análises clínicas é uma atividade que a enfermagem desenvolve e que contribui para a promoção, manutenção e recuperação da saúde. A sofisticação tecnológica laboratorial exige que haja profissionais especializados nessa área, tanto na análise propriamente dita, como na obtenção da matéria prima do laboratório, a amostra biológica, pois mesmo os equipamentos de última geração não conseguirão minimizar os interferentes ocasionados por coleta não adequada ao tipo de exame solicitado.
Frente aos avanços tecnológicos e à necessidade de contínuo aperfeiçoamento dos profissionais que atuam na área, estudos indicaram que o profissional predominante é o auxiliar de enfermagem, referido em 77,8% dos laboratórios. O técnico em enfermagem em 13,3% dos laboratórios. O profissional de nível superior mais frequente é o biomédico que aparece em 51,1% dos laboratórios, seguido pelo enfermeiro, em 33,3% dos laboratórios.
A punção venosa consiste na introdução de um cateter venoso na luz de uma veia periférica, cujas principais indicações são administração de líquidos, medicamentos, hemoderivados, coleta de sangue para exames laboratoriais e para manutenção do acesso venoso no paciente. É considerada uma técnica invasiva visto que o cateter provoca o rompimento da proteção natural e como consequência a comunicação entre o sistema venoso e o meio externo.
A punção venosa periférica constitui-se em uma das atividades mais frequentes realizadas pelos profissionais de saúde, especialmente os profissionais da equipe de enfermagem, sendo que a execução deste procedimento envolve conhecimentos advindos da anatomia, fisiologia, farmacologia, psicologia, entre outros inclusive a destreza manual. Ressalte-se que as punções venosas periféricas representam aproximadamente 85% de todas as atividades executadas pelos profissionais enfermagem e que, por ser considerado um procedimento que possui alto nível de complexidade técnico-científico, exige do profissional competência, bem como habilidade psicomotora.
A NBR NM 322 de 11/2008 - Laboratório clínico - Recipientes de uso único para coleta de sangue humano especifica os requisitos e métodos de ensaio para os recipientes de uso único para a coleta de amostras de sangue venoso com e sem vácuo. Não especifica os requisitos referentes a agulhas nem a suportes para coleta com vácuo. O tubo deve ser fabricado em um material que permita uma visão clara do conteúdo quando submetido a inspeção visual, exceto para a determinação de analitos fotossensíveis. A superfície interior dos tubos destinados a receber amostras para estudos de coagulação, não devem permitir a ativação por contato.
Se um recipiente está destinado especificamente para a determinação de certa sustância, o fabricante deve estabelecer o nível máximo de contaminação da superfície interna do recipiente com dita substância e o método analítico utilizado na sua quantificação e deve também descrever nos documentos que acompanham o produto, na etiqueta ou na embalagem. Para a determinação de metais e outras substâncias especificadas, é recomendado que a composição do material da tampa não interfira com a determinação para não interferir nos resultados.
Os recipientes que contém aditivos promotores de desenvolvimento de micro-organismos tais como o citrato trisódico ou solução de citrato fosfato dextrose adenina, devem ter sido submetidos a um processo validado para eliminar a contaminação microbiana do aditivo e do interior do recipiente. O recipiente deve estar livre de corpos estranhos quando submetido a inspeção visual.
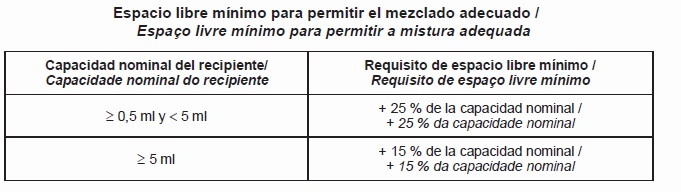
Quando se realizam ensaios de acordo com os métodos especificados nos Anexos A ou B, o volume de água drenado da bureta ou extraído da bureta, deve estar compreendido entre ±10% da capacidade nominal. Para os recipientes com aditivo, deve existir espaço livre suficiente, quando realizar os ensaios de acordo com os métodos especificados nos Anexos A ou B, para permitir a mistura adequada por meios mecânicos ou manuais.
O espaço livre mínimo deve ser o especificado na tabela abaixo, exceto indicação do fabricante segundo o uso previsto. Deve-se levar em conta o fato de que o espaço livre para misturar o conteúdo de um recipiente está limitado pela parte inferior da tampa e o menisco líquido.
A tampa não deve afrouxar-se durante a mistura quando realizada de acordo com os métodos especificados no Anexo C. Quando a tampa está prevista para ser removida para acessar ao conteúdo do recipiente, deve ser projetada de tal modo que possa ser retirada utilizando-se os dedos ou por meios mecânicos, sem que a parte da tampa em contato com a amostra seja tocada pelos dedos.
Quando um recipiente é ensaiado para perda de acordo com o método especificado no Anexo C, não deve ser detectada fluorescência na água em foi submerso. Quando o recipiente contendo a amostra é centrifugado, deve suportar uma velocidade de 3.000 g no seu eixo longitudinal, quando ensaiado de acordo com o método especificado no Anexo D. Quando um recipiente é submetido a inspeção visual, não deve apresentar bordas afiladas, projeções ou asperezas superficiais, capazes de cortar, marcar ou produzir lesão na pele do usuário.
Se um fabricante descreve que o produto é estéril, o interior do recipiente e todo conteúdo deve ter sido submetido a um processo validado, projetado para assegurar que o interior do recipiente, fechado e sem uso, e seu conteúdo, são estéreis. Nos tubos com vácuo a esterilidade é obrigatória devido ao fato de que, durante a coleta de sangue, existe a possibilidade de contato direto entre o interior do recipiente e a circulação sanguínea do paciente.
A validação da eficácia do processo de esterilização é responsabilidade do fabricante. A quantidade nominal descrita de aditivo deve estar dentro do intervalo especificado no Anexo E. O volume de um aditivo líquido num recipiente deve ser determinado gravimetricamente fazendo uma correção pela densidade do líquido.
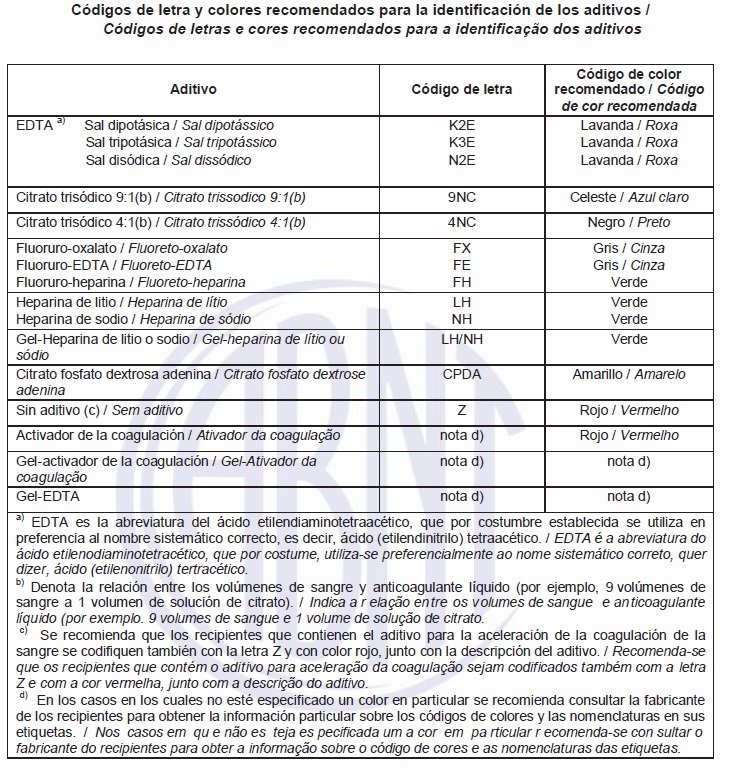
A rotulagem e a etiquetagem da embalagem primária deve permanecer aderida até a data de vencimento do produto. O fabricante é responsável em descrever as condições recomendadas de armazenamento dos documentos que acompanham o produto ou na etiqueta ou embalagem. Cada embalagem primaria deve estar rotulada no exterior com a seguinte informação: nome ou marca comercial do fabricante ou distribuidor; número do lote; data de vencimento; descrição do conteúdo devendo constar: a capacidade nominal; todos os revestimentos (por exemplo ativadores) ou aditivos do tubo; nome de qualquer aditivo ou sua fórmula e/ou o código estabelecido na tabela abaixo; a palavra estéril se o fabricante declara que o interior do recipiente sem abrir e todo seu conteúdo é estéril ou o símbolo gráfico; as palavras de uso único ou símbolo gráfico de acordo com a ISO 7000; os requisitos de armazenamento.
Se o recipiente está destinado especificamente para a determinação de certa substância, deve ser descrito na etiqueta da embalagem primária, o nível máximo de contaminação com esta substância. Por exemplo: se é utilizado glicerol na fabricação do recipiente, é recomendado declarar na etiqueta ou na embalagem primária.
As etiquetas não devem envolver completamente os tubos. A rotulagem do recipiente deve permanecer aderida até a data de vencimento do produto. Os recipientes devem ter a informação seguinte marcada diretamente sobre o tubo ou na etiqueta: nome ou marca comercial do fabricante ou provedor; número do lote; código de letra ou tipo de aditivo contido (ver tabela abaixo). Quando se utilizam outros aditivos que não se encontram na tabela abaixo, o recipiente deve ser identificado mediante a descrição do aditivo.
Deve-se especificar a concentração do aditivo contido, quando corresponde, por exemplo: citrato trisódico 0,105 M ou 0,129 M; data do vencimento; capacidade nominal; marca de limite, onde for necessário, como no caso dos recipientes sem vácuo; a palavra estéril se o fabricante declara que o interior do recipiente sem abrir e todo o seu conteúdo são estéreis.
Enfim, a coleta de sangue é amplamente praticada e continua sendo de inestimável valor para o diagnóstico e tratamento de vários processos patológicos. O teste de laboratório é parte integrante do processo de tomada de decisão do médico e os resultados influenciam diretamente a qualidade de vida do paciente.
Os avanços em tecnologia de instrumentos e o investimento em automação simplificaram os processos no diagnóstico laboratorial, melhorando a qualidade dos resultados. Porém, a grande questão enfrentada hoje é que cerca de 70% do total de erros que afetam os resultados dos testes laboratoriais ocorre na fase pré-analítica. Isso se deve principalmente à dificuldade em obter procedimentos padronizados para a coleta de amostras.
Os testes de laboratório são divididos três fases: pré-analítica, analítica e pós-analítica. A fase pré-analítica compreende todos os processos a partir do momento em que um médico solicita o exame até que a amostra seja enviada para análise no laboratório. Inclui então a indicação do exame, instruções de preparo do paciente, procedimentos de coleta de sangue, armazenamento, preservação e transporte da amostra.
Claro que qualquer uma das fases pode apresentar erros de processo, sendo que a maioria dos erros são identificados na fase analítica. Entretanto, eles apenas refletem a falta de cuidados durante a fase pré-analítica, com os fatores que afetam diretamente a amostra.
As boas práticas e sistematização da fase pré-analítica, principalmente no processo de coleta da amostra, evita uma série de erros, retrabalhos e desperdícios de amostras e de reagentes, evitando danos aos pacientes e também ao laboratório. Na coleta de sangue para a realização de exames laboratoriais é importante que se conheça, controle e, se possível, evite algumas variáveis que possam interferir na exatidão dos resultados. A primeira delas é a condição do paciente e as orientações que devem ser passadas antes do exame.